- Умный справочник
- Физика
- Уравнение Менделеева-Клапейрона. ОГЗ. Изопроцессы.
Уравнение Менделеева-Клапейрона. ОГЗ. Изопроцессы.
Уравнение Менделеева-Клапейрона
Есть законы, без которых даже заходить на ЕГЭ по физике не стоит. Это один из них. И все дело в большом количестве величин, которые связывает это уравнение. Получить его можно из формулы, которую мы уже использовали в предыдущей статье (p=nkT):
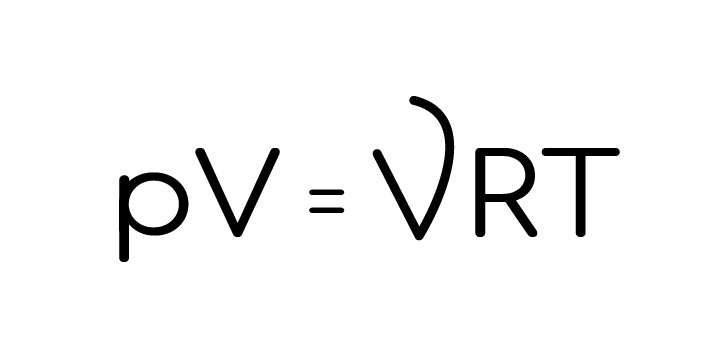
Оно связывает все параметры, определяющие состояние газа: давление, объем, температуру. Поэтому оно постоянно используется в разных задачах, и не надейся не встретиться с ним в ЕГЭ, при чем и в первой, и во второй части.
Кстати без предыдущей статьи тут делать нечего, машина без двигателя не поедет.
Хитрость, которая ломает судьбы бедных школьников, когда в задаче на молекулярку просят найти плотность, а в уравнении Менделеева-Клапейрона ее нет.
Не горячись. Сейчас покажу как ее легко там сделать. Коротенький вывод:
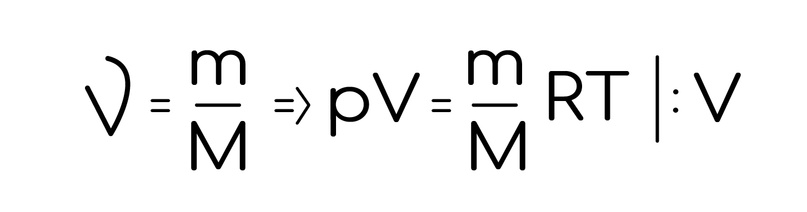
И вспоминая еще одну до невозможности важную формулу, которая попадается везде (по секрету, это про массу, которая равна плотности, умноженной на объем) мы получаем:
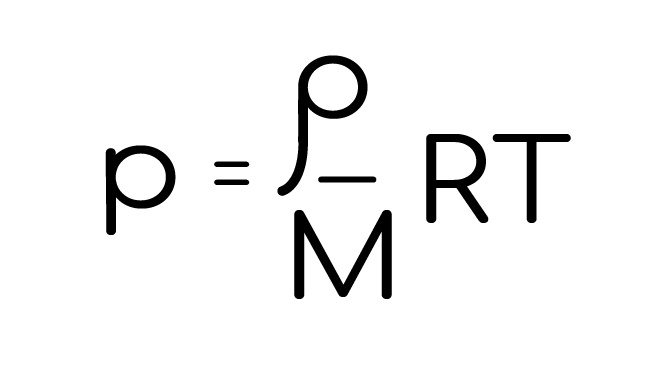
Откуда ты и выразишь искомую плотность. Броо, да мы дрим тим, едем дальше.
Объединенный газовый закон
А теперь то, что вывел господин Клапейрон на основе уравнения. Состояние газа, как мы говорили, описывается через давление, температуру и объем. А это соотношение, остается постоянным для ДАННОГО количества газа при любом наборе этих величин:
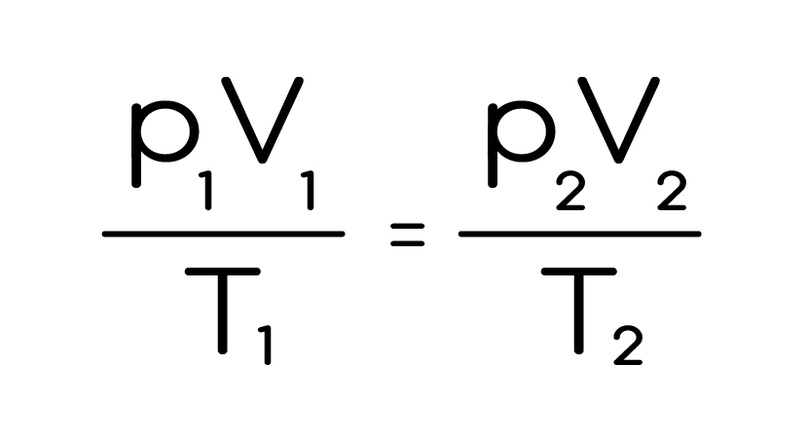
А теперь внимательно послушай:
Это и предыдущее уравнение (Менделеева-Клапейрона) ни в коем случае нельзя забывать, при решении задач всего раздела молекулярной физики.
Как в первой, так и во второй части, эти формулы встретятся в любом варианте ЕГЭ, будь к этому готов.
Но часто при переводе газа из одного состояния в другое, меняются не все три величины сразу, какая-то из них может оставаться без изменения.
Изопроцессы
Да, задачи делают специально такие, чтобы одна из переменных была константой (хотя и в жизни такие процессы очень распространены). Например, нагревают газ, а объем при этом увеличивается так, что давление остается постоянным. Или тот же газ нагревают, но в закрытом жестком сосуде, так что повышается давление, а объем поменяться уже не может.
Изобарный процесс
Так как сейчас в ЕГЭ могут попадаться вопросы с фамилиями умников, которые выводили эти законы, придется их тоже давать.
Закон Гей-Люссака – изменение состояния при постоянном давлении:
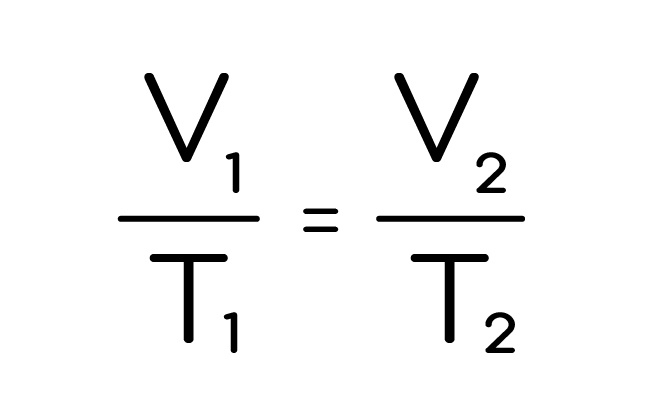
Логика, кстати, простая, я бы тоже так уравнения хотел открывать: взять объединенный газовый закон, при постоянной p ее можно просто сократить и получится изобарный процесс. Так будет и с остальными переменными.
Полезно видеть и графики этих процессов, они тоже часто мелькают. Вот так выглядит изобара в разных системах координат. Если хорошо все с математикой, то эти графики покажутся совсем простыми и логичными. Обрати внимание, что наклонные графики обязательно проходят через ноль:
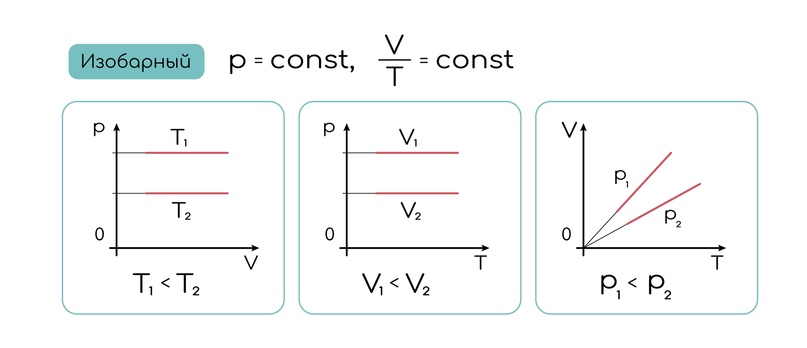
Изохорный процесс
Закон Шарля – изменение состояния газа при постоянном объеме. Все также, он просто вычеркнул постоянный объем из того же закона и получил свой:
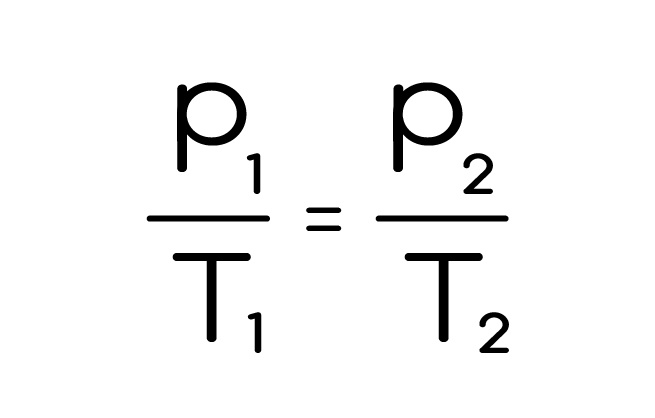
Графики изохоры в различных координатах:
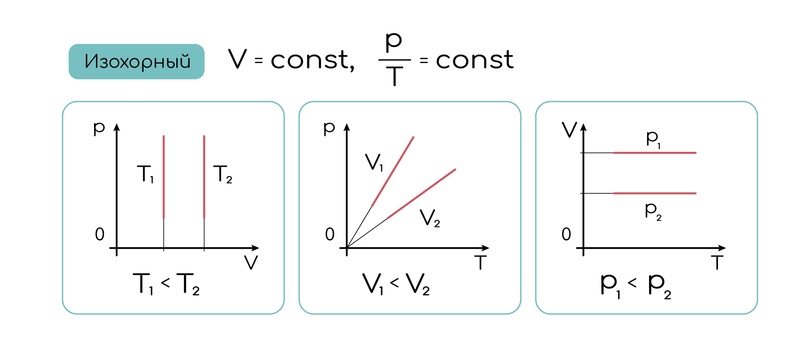
Изотермический процесс
Закон Бойля-Мариотта – изменение состояния газа при постоянной температуре. Они тоже не были оригинальными и просто убрали постоянную температуру и получили:
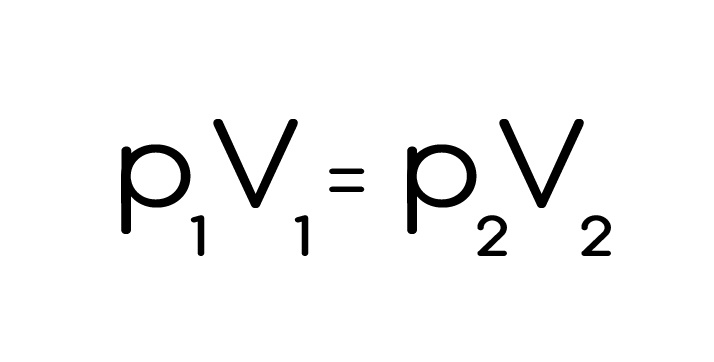
Так как тут температура была в знаменателе, то график изотермы будет интереснее:
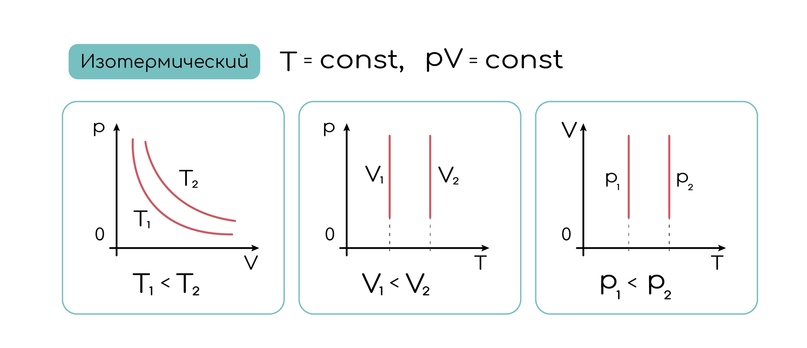
Главное помни: все это работает при постоянной массе газа, ни добавлять другие, ни убирать этот нельзя, тогда состояние будет уже другого количества газа. А формулы начала, надеюсь, ты уже выучил.