- Умный справочник
- Химия
- Металлы
Металлы
С точки зрения химических свойств металлы делятся на три группы: активные металлы, металлы средней активности, неактивные (тяжелые) металлы.
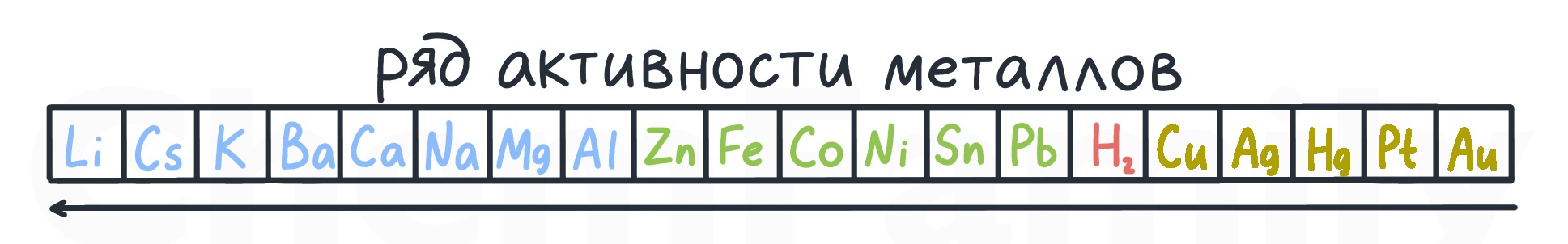
Неактивные металлы — металлы правее водорода в ряду активности металлов. Граница же между активными металлами и металлами средней активности в неорганике уже не такая четкая. Только в электролизе Al это четко последний активный металл.
Точно являются активными щелочные (Li, Na, K, Rb, Cs, Fr) и щелочно-земельные (Ca, Sr, Ba, Ra) металлы. Магний и алюминий чаще всего считаются уже металлами средней активности.
Приятного изучения статьи! Если хочешь подготовиться на 90+, то обязательно посмотри вот эти способы подготовки (жми, чтобы перейти на сайт и узнать подробнее) 💜
Общие для всех металлов свойства
С кислотами неокислителями взаимодействуют только металлы левее водорода:
Zn + HCl → ZnCl₂ +H₂
С кислотами окислителями (HNO₃ и концентрированная H₂SO₄) взаимодействуют почти все металлы кроме самых неактивных (Au, Pt). Чтобы понять, во что восстановится кислота, смотри статьи по соединениям серы и азота:
Cu + HNO₃(конц) → Cu(NO₃)₂ + NO₂ + H₂O
Fe + H₂SO₄(конц) → Fe₂(SO₄)₃ + SO₂ + H₂O
Со щелочами взаимодействуют только Zn и Al:
Al + KOH + H₂O → K[Al(OH)₄] + H₂
Zn + KOH + H₂O → K₂[Zn(OH)₄] + H₂
Более активные металлы вытесняют менее активные из растворов их солей. Щелочные и щелочно-земельные металлы в эту реакцию не вступают, так как прореагируют с водой:
Zn + CuCl₂ → ZnCl₂ + Cu
С оксидами металлов в ЕГЭ реагируют алюминий (алюмотермия) и магний (магнийтермия). При этом надо брать оксид металла, расположенного правее алюминия или магния в ряду активности металлов:
Al + Cr₂O₃ → Cr + Al₂O₃
Из оксидов неметаллов попадалось окисление металлов с помощью NO₂ и CO₂:
Zn + NO₂→ ZnO + N₂
Cu + NO₂ → CuO + N₂
Zn + CO₂ → ZnO + CO
Mg + CO₂ → MgO + C
Щелочные и щелочно-земельные металлы реагируют с водой активно и со взрывом:
Na + H₂O → NaOH + H₂
Металлы средней активности могут реагировать с водой при нагревании и после удаления с поверхности металла оксидной пленки. Но в ЕГЭ такое практически не попадается:
Al + H₂O → Al(OH)₃ + H₂
Алюминий
После удаления с поверхности оксидной пленки алюминий активно взаимодействует с водой:
Al + H₂O → Al(OH)₃ + H₂
Алюмотермия:
Cr₂O₃ + Al → Cr + Al₂O₃
Сплавление оксида алюминия с карбонатами щелочных металлов:
Al₂O₃ + Na₂CO₃ → NaAlO₂ + CO₂
Взаимодействие со щелочами:
Al + KOH + H₂O → K[Al(OH)₄] + H₂
Хром
При окислении соединений Cr⁺³ в щелочной среде образуются хроматы, так как они устойчивы в щелочной среде:
Cr₂O₃ + NaNO₃ + NaOH → Na₂CrO₄ + NaNO₂ + H₂O
В щелочной среде дихроматы переходят в хроматы:
Na₂Cr₂O₇ + NaOH → Na₂CrO₄ + H₂O
В кислой среде хроматы переходят в дихроматы:
Na₂CrO₄ + H₂SO₄→ Na₂Cr₂O₇ + Na₂SO₄ + H₂O
Окисление дихроматом в кислой среде:
K₂SO₃ + K₂Cr₂O₇ + H₂SO₄ → K₂SO₄ + Cr₂(SO₄)₃ + H₂O
Окисление водным раствором дихромата:
K₂SO₃ + K₂Cr₂O₇ + H₂O → Cr(OH)₃ + K₂SO₄ + KOH
Сплавление Cr₂O₃ с карбонатами:
Cr₂O₃ + Na₂CO₃ → NaCrO₂ + CO₂
Марганец
При окислении в кислой среде перманганат восстанавливается до Mn²⁺:
K₂SO₃ + KMnO₄ + H₂SO₄ → K₂SO₄ + MnSO₄ + H₂O
При окислении в нейтральной среде перманганат восстанавливается до MnO₂, а также образуется щелочь:
KMnO₄ + K₂SO₃ + H₂O → K₂SO₄ + MnO₂ + KOH
При окислении в щелочной среде перманганат восстанавливается до манганата:
KMnO₄ + K₂SO₃ + KOH → K₂SO₄ + K₂MnO₄ + H₂O
Железо
Окисление соединений Fe⁺² или Fe⁺³ хлором или бромом в щелочной среде:
Fe₂O₃ + Br₂ + NaOH → Na₂FeO₄ + NaBr + H₂O
При окислении в кислой среде феррат восстанавливается до Fe⁺³:
Na₂SO₃ + Na₂FeO₄ + H₂SO₄ → Na₂SO₄ + Fe₂(SO₄)₃ + H₂O
Если в реакции участвуют соединения Fe⁺², то надо внимательно следить за тем, нет ли взаимодействия с окислителями и окисления до Fe⁺³:
FeS + HCl → FeCl₂ + H₂S — т.к. HCl кислота неокислитель
FeS + HNO₃ → Fe(NO₃)₃ + H₂SO₄ + NO₂ + H₂O — т.к. HNO₃ кислота окислитель
Кислоты окислители окисляют Fe до Fe⁺³, а кислоты неокислители только до Fe⁺²:
Fe + HCl → FeCl₂ + H₂ — т.к. HCl кислота неокислитель
Fe + HNO₃(конц) → Fe(NO₃)₃ + NO₂ + H₂O — т.к. HNO₃ кислота окислитель
Fe₃O₄ — смесь FeO и Fe₂O₃, поэтому при взаимодействии с кислотой неокислителем образуются одновременно соединения Fe⁺² и Fe⁺³:
Fe₃O₄ + HCl → FeCl₂ + FeCl₃ + H₂O
Соли Fe⁺³ могут окислять некоторые металлы. Не перепутай это с вытеснением:
FeCl₃ + Cu → FeCl₂ + CuCl₂
Медь
Cu⁺² это окислитель, про который все забывают:
CuCl₂ + KI → CuI + I₂ + KCl
В этой реакции нельзя писать CuCl вместо CuI. И CuCl, и CuI нерастворимы, но CuI во много раз более нерастворим, чем CuCl, поэтому именно CuI выпадет в осадок.
