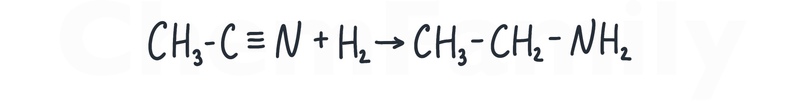Амины
Амины — органические вещества, содержащие группу -NH₂.
Молекулярная формула — CnH(2n+3)N.
Если нужно найти молекулярную формулу диметиламина, в котором 2 углерода, то получаем C₂H₂x₂₊₃N → C₂H₇N.
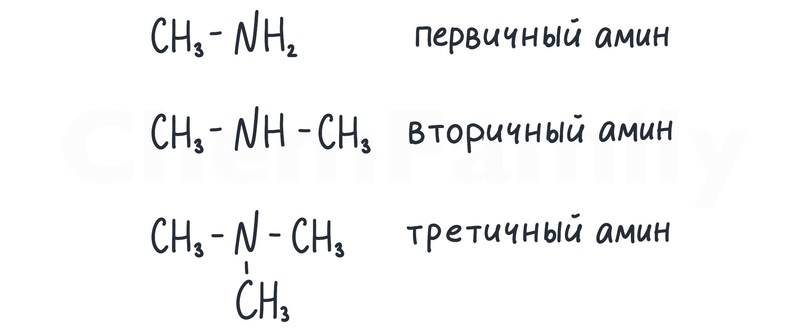
Амины бывают трех видов:
Приятного изучения статьи! Если хочешь подготовиться на 90+, то обязательно посмотри вот эти способы подготовки (жми, чтобы перейти на сайт и узнать подробнее) 💜
Номенклатура
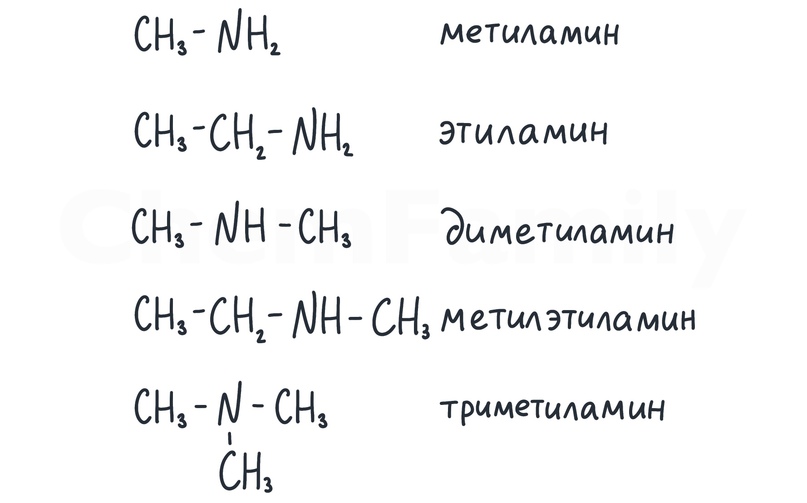
Также нужно уметь называть соли аминов.

Основные свойства аминов
Амины являются органическими основаниями. Есть много разных теорий про то, что считать кислотой, а что основанием. Самая простая из них говорит о том, что кислота это то, что способно отщеплять H⁺, а основание – OH⁻. Чаще всего это работает хорошо: HCl это кислота, потому что диссоциирует с образованием H⁺, а KOH это основание, потому что диссоциирует с образованием OH⁻.
Но NH₃ это же тоже основание. И, как основание, он реагирует с кислотами. Но при этом OH⁻ не отщепляет. И тут становится нужна другая теория кислот и оснований, которая говорит о том, что основание это то, что содержит неподеленную электронную пару и может ею поделиться. Действительно, в NH₃ у азота есть неподеленная электронная пара, с помощью которой и образуется донорно-акцепторная связь с H⁺, в результате чего формируется ион NH₄⁺.
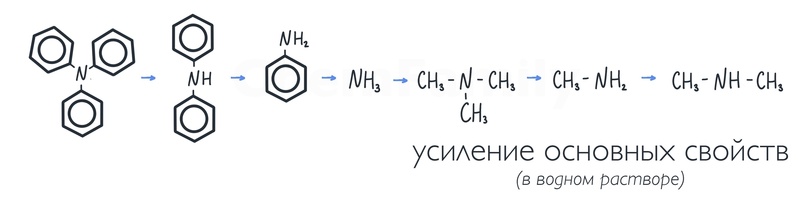
У аминов такой же механизм «работы». Таким образом, если неподеленная электронная пара азота становится более доступной для взаимодействия с H⁺, то основные свойства становятся более выраженными. CH₃– группа «выталкивает» неподеленную электронную пару, поэтому метиламин имеет более основные свойства, чем аммиак. А диметиламин тогда основнее метиламина. Триметиламин тогда должен быть более основным, чем диметиламин, но нет. Три CH₃– группы имеют настолько большой размер, что скрывают неподеленную электронную пару, поэтому основность триметиламина резко падает. Фенильный радикал же, наоборот, «втягивает» неподеленную электронную пару в себя, поэтому анилин оказывается менее основным, чем аммиак. Соответственно, дифениламин будет еще менее основным, а трифениламин наименее основным.
Этот ряд справедлив только для водных растворов аминов.
Взаимодействие с кислотами
Амины являются органическими основаниями, поэтому для них характерно взаимодействие с кислотами.
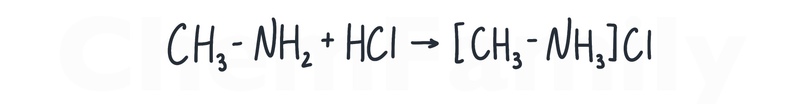
Алкилирование
Алкилирование — внедрение в молекулу углеводородного радикала. В результате алкилирования аминов образуются соли.
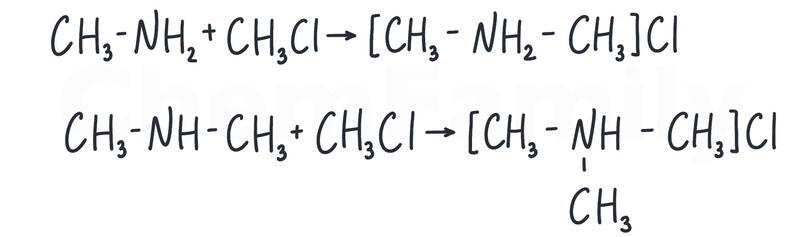
Взаимодействие с азотистой кислотой
Разные виды аминов реагируют по-разному. Взаимодействие с первичными аминами встречается как в 1 части, так и во 2, поэтому надо знать его подробно. Взаимодействие со вторичными аминами встречается только в 1 части, поэтому тут достаточно знать только то, что реакция просто идет с образованием желтого нитрозамина. Насчет возможности взаимодействия третичных аминов с азотистой кислотой мнения расходятся, поэтому в ЕГЭ это не встретится.
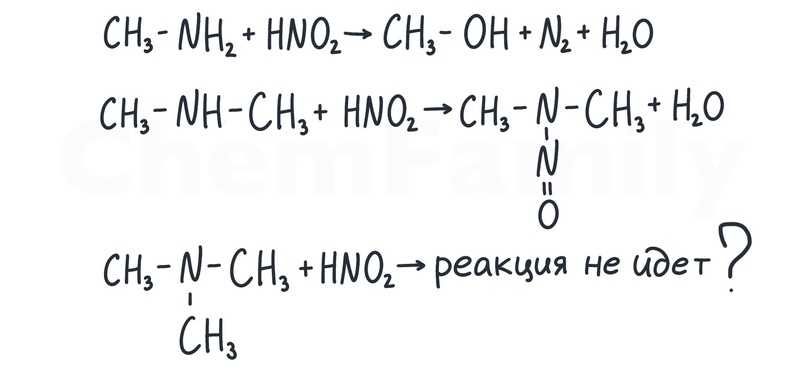
Взаимодействие с водой
Как и NH₃, амины реагируют с водой.
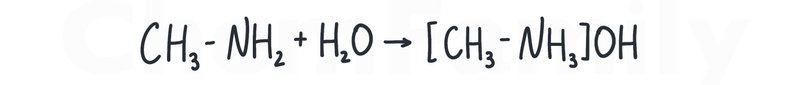
Насчет возможности взаимодействия анилина с водой мнения расходятся.
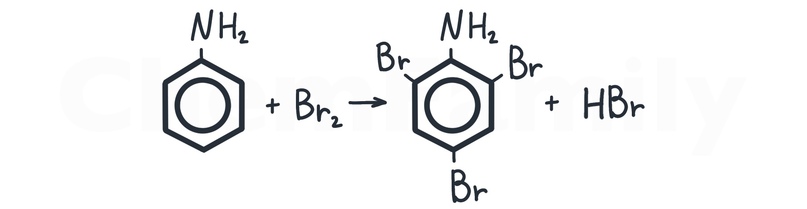
Взаимодействие анилина с бромной водой
Группа -NH₂ делает бензольное кольцо более активным, поэтому для взаимодействия с Br₂ НЕ надо использовать катализатор AlBr₃. В результате реакции образуется белый осадок 2,4,6-триброманилина.
Аммонолиз одноатомных спиртов
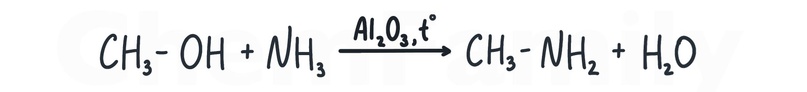
Гидрирование нитросоединений
В качестве источника водорода используется цинк или железо в соляной кислоте. Идея в том, что при их взаимодействии образуется высокоактивный атомарный водород, который и восстанавливает -NO₂ в -NH₂.
Эту реакцию можно встретить в 2 видах. В упрощенном виде Zn/HCl пишется над стрелкой в качестве «катализатора» и в продуктах получается амин. Так сейчас не пишут (оставил, чтобы если ты это встретишь, то оно тебя не пугало).
Сейчас надо писать Zn и HCl в реагенты, а в продуктах писать не амин, а его соль. Реакция же идет в кислой среде, вот амин с этой кислотой реагировать и будет, все логично.
Еще можно встретить гидрирование нитросоединений просто в присутствии Pt, Pd или Ni.
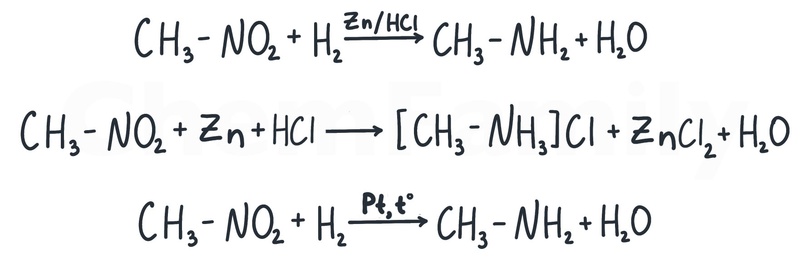
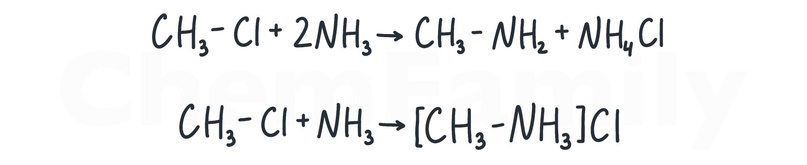
Взаимодействие галогеналканов с аммиаком
В зависимости от количества добавляемого аммиака может образоваться либо сам амин, либо его соль.
неФИПИшные реакции
Дальше идут реакции, которые в ЕГЭ не попадались (неФИПИшные), но попадались в разных авторских сборниках для подготовки. Их можно выучить, но не в первую очередь. И во второй части я бы их не писал, если есть аналогичные ФИПИшные реакции.
Гидрирование нитрилов