Арены
Арены — углеводороды, содержащие бензольное кольцо.
Бензольное кольцо можно изображать любым из двух способов.
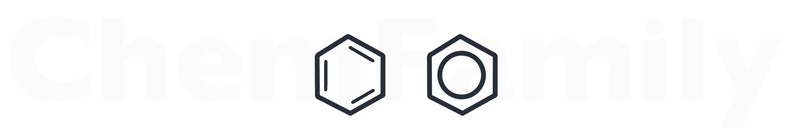
Молекулярная формула CnH2n-6.
Если нужно найти молекулярную формулу толуола (метилбензола), в котором 7 углеродов, то получаем C₇H₂x₇₋₆ → C₇H₈.
При комнатной температуре бензол и толуол — жидкости. В дальнейшем с увеличением количества углеродов и бензольных колец арены становятся твердыми.
Бензольное кольцо характеризуется высокой стабильностью. Поэтому для реакций с бензольным кольцом часто приходится использовать катализаторы и нагревание.
Приятного изучения статьи! Если хочешь подготовиться на 90+, то обязательно посмотри вот эти способы подготовки (жми, чтобы перейти на сайт и узнать подробнее) 💜
Номенклатура аренов
Одно и то же вещество можно назвать несколькими способами.
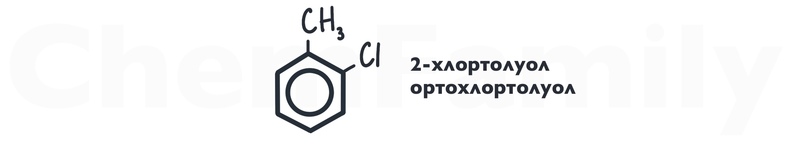
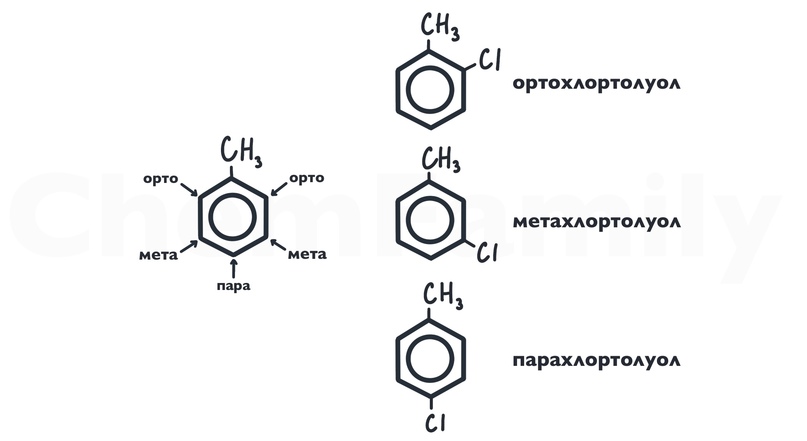
Для положений бензольного кольца существует своя система названий.
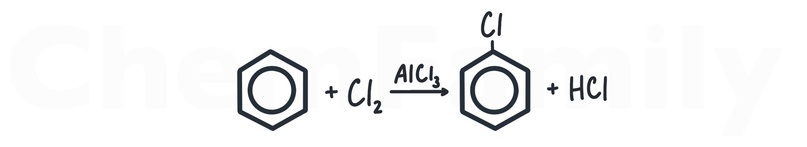
Галогенирование бензола
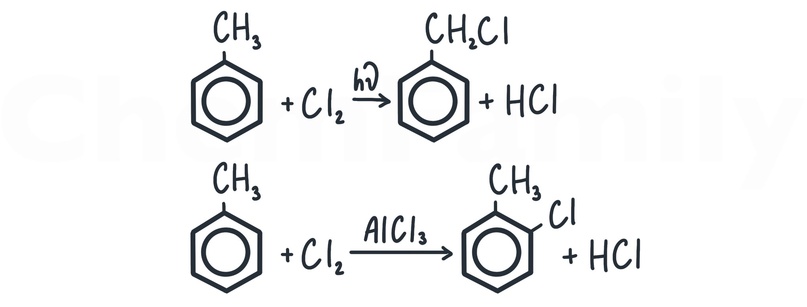
Для взаимодействия с галогенами (Cl₂, Br₂, I₂) используется один из двух катализаторов — соответствующий галогенид алюминия (AlHal₃) или железа III (FeHal₃). То есть, если хлорирование, то катализаторы — AlCl₃ или FeCl₃. Если бромирование, то AlBr₃ или FeBr₃. Когда галоген встает в бензольное кольцо, он выбивает из него атом водорода, который соединяется с оставшимся галогеном с образованием галогеноводорода (HCl, HBr или HI).
Для бромирования надо брать газообразный бром, не бромную воду.
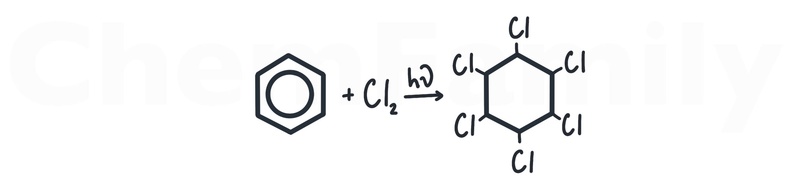
Хлорирование бензола на свету
Добавление хлора к бензолу на свету (свет, УФ или hv над стрелкой) приводит к разрушению бензольного кольца и образованию 1,2,3,4,5,6-гексахлорциклогексана (гексахлорана).
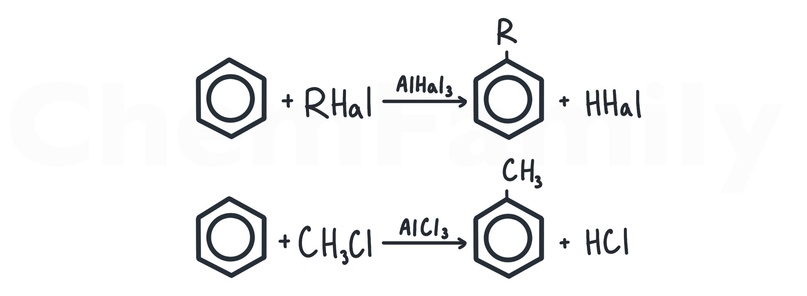
Алкилирование бензола по Фриделю-Крафтсу
Алкилирование — присоединение углеводородного радикала. Для того, чтобы присоединить радикал R, его нужно связать с галогеном (R-Hal) и использовать катализатор AlHal₃ или FeHal₃. Вставая в бензольное кольцо, алкильный радикал выбивает из него атом водорода, который соединяется с оставшимся галогеном с образованием галогеноводорода.
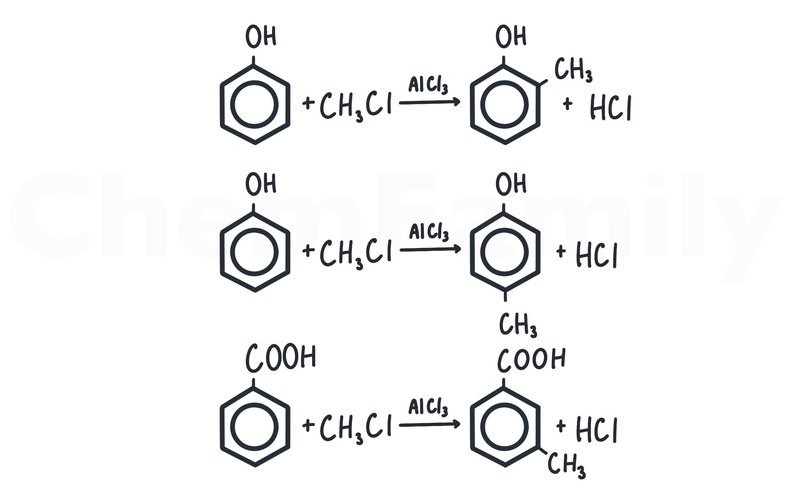
Заместители 1 и 2 рода
В зависимости от того, с какой модификацией бензола проводится реакция, галоген, алкильный радикал и т.п. могут присоединяться к разным положениям бензольного кольца.
Заместители 1 рода (ориентируют в орто или пара положения):
- Углеводородный радикал
- Галоген (-F, -Cl, -Br, -I)
- -OH
- -NH₂
Заместители 2 рода (ориентируют в мета положение):
- -COOH
- -CHO
- -NO₂
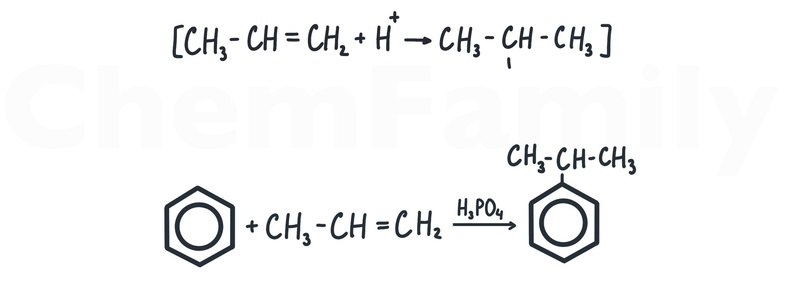
Алкилирование бензола алкенами
Алкилирование алкенами идет в кислой среде (лучше использовать H₃PO₄). Могут встретиться варианты этой реакции, где в катализаторах еще присутствует AlCl₃.
Важно предварительно написать реакцию активации алкена в кислой среде (водород идет к тому углероду при двойной связи, где больше H), чтобы понять каким углеродом он присоединится к кольцу.
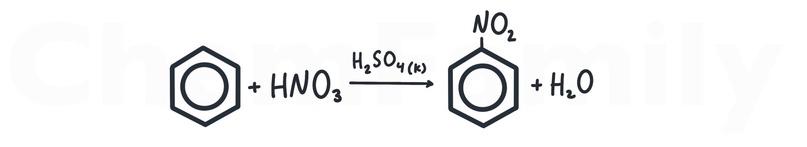
Нитрование бензола
В качестве катализатора используется концентрированная H₂SO₄. Когда -NO₂ встает в кольцо, она вытесняет H, который соединяется с оставшимся от азотной кислоты OH и образуется побочный продукт H₂O.
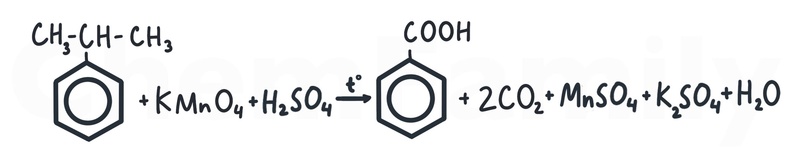
Окисление гомологов бензола
Гомологи — вещества, отличающиеся друг от другу на одну или несколько групп -CH₂-.
Например, этан и пропан — гомологи. Бензол и толуол — гомологи.
Но этандиол-1,2 и пропантриол-1,2,3 гомологами не являются.
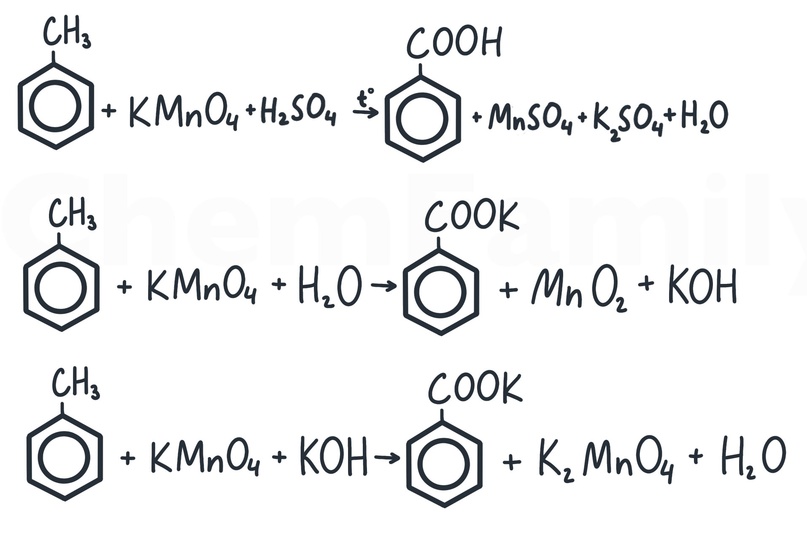
Вне зависимости от того, какой углеводородный радикал будет у бензола, он всегда обрезается до группы -COOH по стандартным правилам жесткого окисления (см. статью про алкены).
В качестве окислителя можно использовать любой раствор KMnO₄. Но надо помнить, что в щелочной и нейтральной среде будет получаться не -COOH группа, а соль. Если в продуктах получаются взаимодействующие вещества, то надо написать продукт их взаимодействия. Например, оставлять не KOH и CO₂ в продуктах, а написать KHCO₃.
Если в качестве окислителя брать подкисленный серной кислотой раствор K₂Cr₂O₇, то в побочных продуктах будет Cr₂(SO₄)₃, K₂SO₄ и H₂O.
Гидрирование бензола
Для присоединения водорода используется один из трех катализаторов — Pt, Pd или Ni. При этом бензольное кольцо разрушается и образуется циклогексан.
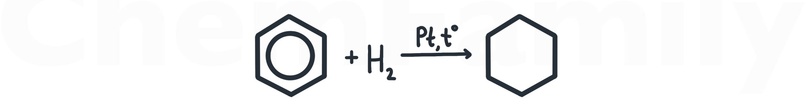
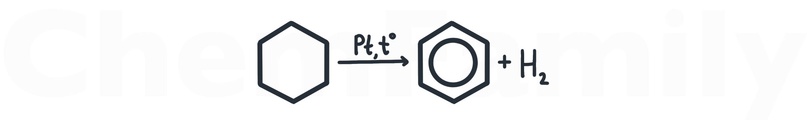
Дегидрирование циклогексана
Для дегидрирования циклогексана используется нагревание вместе с одним из трех катализаторов — Pt, Pd или Ni.
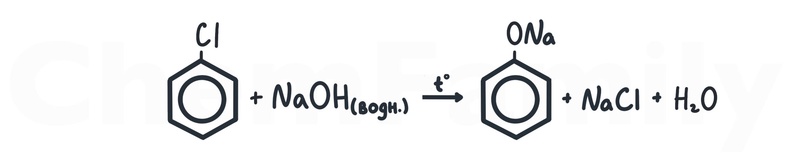
Получение фенола из хлорбензола
Вроде бы обычная реакция хлорбензола с водным раствором щелочи. Но есть очень важный момент – температура. Без температуры эта реакция не идет, и эта тонкость встречается на ЕГЭ. При этом получается не сам фенол, а его соль, так как получившийся фенол реагирует с NaOH.
Реакции с производными бензола
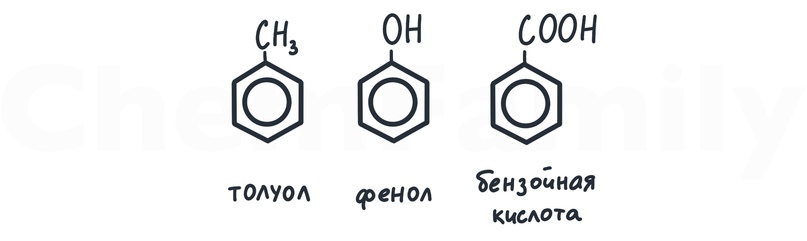
Производные бензола (толуол, фенол, бензойная кислота) обычно содержат 2 функциональные группы.
- толуол = бензольное кольцо + углеводородный радикал
- фенол = бензольное кольцо + спиртовая группа
- бензойная кислота = бензольное кольцо + карбоксильная группа
Поэтому в зависимости от условий реакция может идти либо с бензольным кольцом, либо с другой функциональной группой.
Реакция Зелинского
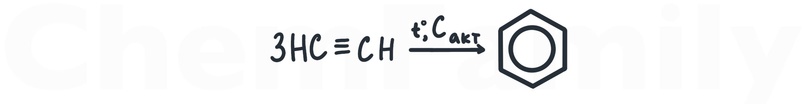
Тримеризация пропина
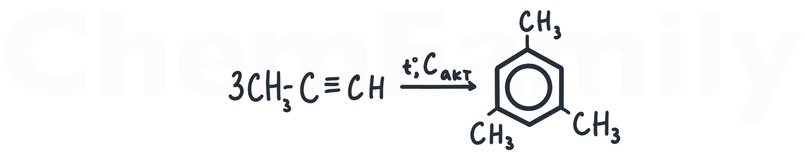
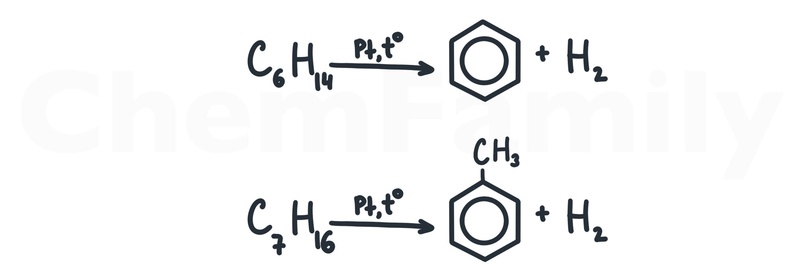
Риформинг (дегидроциклизация) алканов
В качестве катализатора используется Cr₂O₃. Однако нужно помнить, что Cr₂O₃ может быть использован и для обычного дегидрирования алканов!
В реакцию риформинга вступают только гексан и гептан.
неФИПИшные реакции
Дальше идут реакции, которые в ЕГЭ не попадались (неФИПИшные), но попадались в разных авторских сборниках для подготовки. Их можно выучить, но не в первую очередь. И во второй части я бы их не писал, если есть аналогичные ФИПИшные реакции.
Сульфирование бензола
При взаимодействии бензола с серной кислотой образуется бензолсульфокислота.

