- Умный справочник
- Химия
- Алканы
Алканы
Алканы — углеводороды, в которых все связи насыщенные.
Насыщенные связи = одинарные связи.
Ненасыщенные связи = двойные или тройные связи (то есть их можно насытить водородом и превратить в одинарные).
Молекулярная формула алканов CnH2n+2.
Если нужно найти молекулярную формулу гептана, в котором 7 углеродов, то получаем C₇H₂×₇₊₂ → C₇H₁₆.
Низкомолекулярные алканы (С₁-С₄) — газы. С увеличением количества углеродов алканы становятся жидкостями, а потом твердыми веществами.
В целом алканы являются достаточно инертными веществами, поскольку для разрыва связей C-C необходимо много энергии.
Приятного изучения статьи! Если хочешь подготовиться на 90+, то обязательно посмотри вот эти способы подготовки (жми, чтобы перейти на сайт и узнать подробнее) 💜
Галогенирование алканов
Алканы довольно инертны, поэтому для галогенирования им нужна дополнительная энергия. Хлорирование обычно идет при УФ-облучении (hν или УФ над стрелкой), бромирование при нагревании.
Для бромирования надо брать газообразный бром, не бромную воду.
С фтором алканы взаимодействуют, но в ЕГЭ это не попадалось. С йодом алканы не взаимодействуют.
При хлорировании молекула хлора разрывается пополам: один хлор связывается с алканом, выбивая из него водород, а второй хлор связывается с выбитым водородом, образуя HCl.
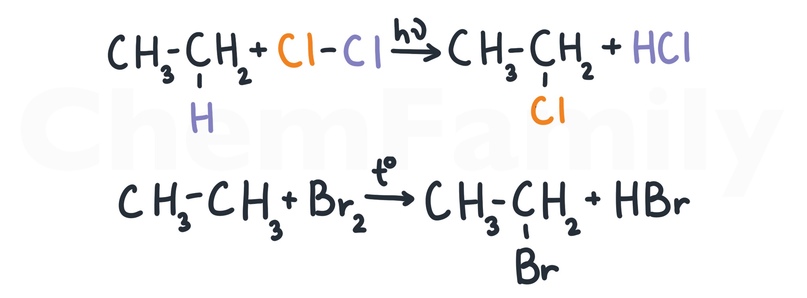
Если алкан несимметричный, то галоген встает к тому атому углерода, у которого меньше всего атомов водорода.
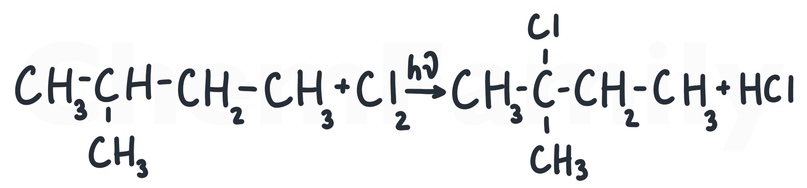
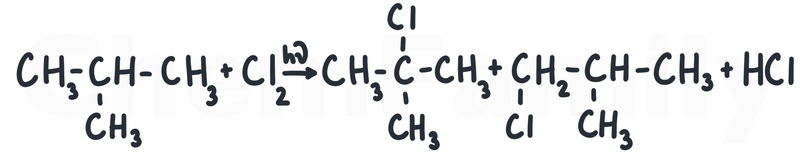
Реакция идет по свободно-радикальному механизму. Для нас это значит то, что реакция не всегда идет по описанной выше схеме. То есть, хлор может вставать и к другим атомам углерода, но такие продукты получаются в заметно меньших количествах (и во второй части писать эти продукты не нужно).
Нитрование алканов (реакция Коновалова)
Из-за инертности алканов для протекания реакции необходимо нагревание.
Для реакции так же характерен свободно-радикальный механизм. А азотную кислоту надо брать разбавленную.
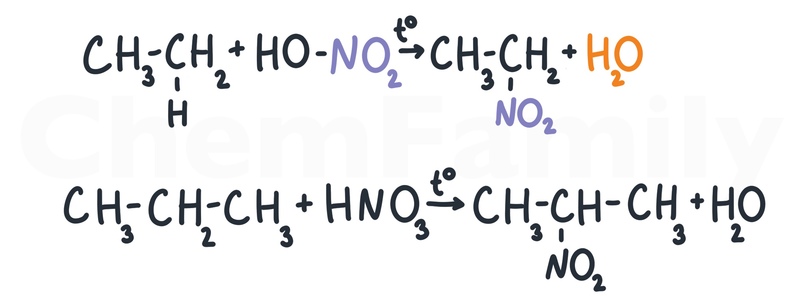
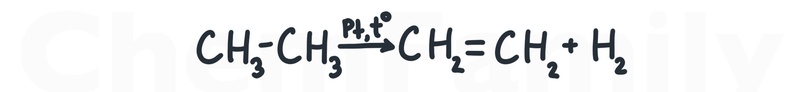
Дегидрирование алканов
Для дегидрирования можно использовать любой из 3 классических катализаторов: Pt, Pd или Ni. Также может быть использован Cr₂O₃, но он используется и для риформинга (см. дальше).
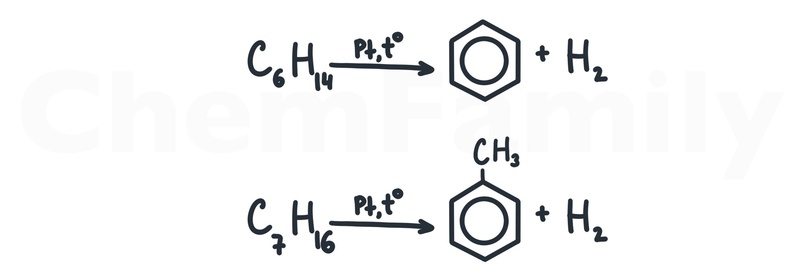
Риформинг (дегидроциклизация, ароматизация) алканов
В качестве катализатора используется Pt или Cr₂O₃. Однако нужно помнить, что и Pt, и Cr₂O₃ могут быть использованы и для обычного дегидрирования!
В этой реакции 6 углеродов всегда замыкаются в бензольное кольцо. Если в исходном алкане будет более 6 углеродов, то 6 углеродов так же образуют бензольное кольцо, но на нем в качестве радикалов будут «лишние» углероды.
Крекинг (пиролиз) мелких алканов
Если нагреть метан или этан до 1200-1500⁰С, образуется ацетилен. Над стрелкой важно указывать точную температуру, лучше 1200⁰С или 1500⁰С.
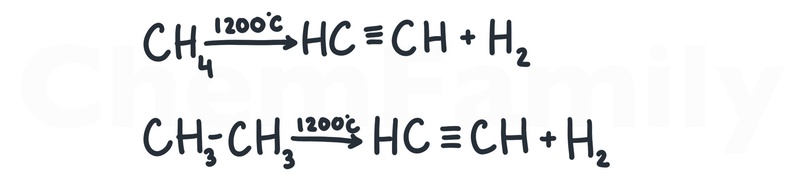
Если нагреть метан до 700⁰С, то он разложится на углерод и водород.

Реакция Вюрца
Реакция в общем виде: R — любой радикал. Hal — любой галоген (F, Cl, Br, I). Обязательно брать натрий.
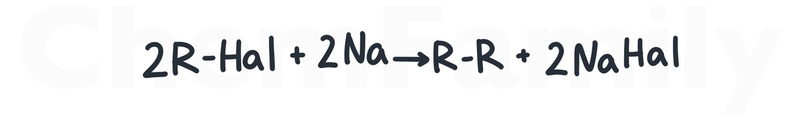
Важно! Реакция Вюрца может проводиться в том числе и с 2 разными веществами.

Изомеризация алканов
Изомеры — вещества с одинаковой молекулярной формулой, но разной структурной формулой.
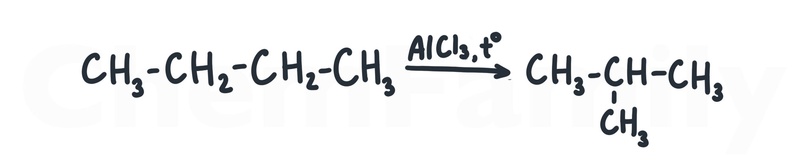
Каталитическое окисление бутана
Понятно, что окисление связано с изменением степеней окисления. Но в органике, по-простому, можно сказать, что окисление это введение в молекулу атомов кислорода. Тогда получается все логично. Бутан разрезается пополам, а в получившиеся фрагменты из двух углеродов вводятся атомы кислорода – получаются карбоновые кислоты.
В эту реакцию вступает только бутан. Катализатор над стрелкой можно указать в общем виде (просто «кат.»).
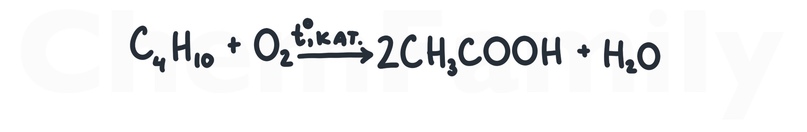
Гидролиз карбида алюминия
В эту реакцию вступает только Al₄C₃. С другими карбидами будут другие продукты.
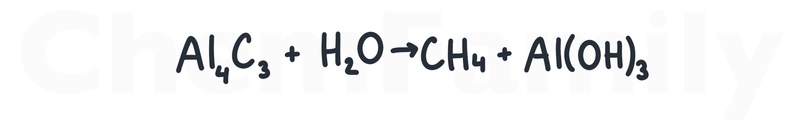
Декарбоксилирование солей карбоновых кислот (реакция Дюма)
Сплавление соли карбоновой кислоты с твердой щелочью.
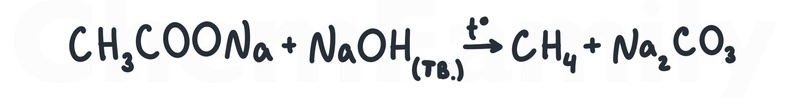
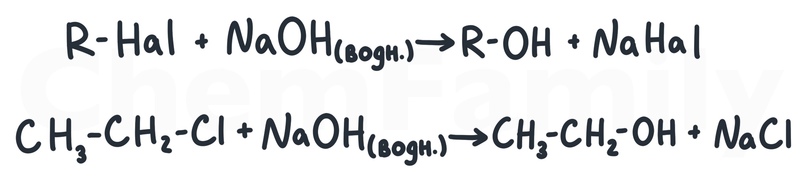
Взаимодействие галогеналкана с водным раствором щелочи
Важно указать, что раствор водный.
неФИПИшные реакции
Дальше идут реакции, которые в ЕГЭ не попадались (неФИПИшные), но попадались в разных авторских сборниках для подготовки. Их можно выучить, но не в первую очередь. И во второй части я бы их не писал, если есть аналогичные ФИПИшные реакции.
Крекинг крупных алканов
При крекинге крупных алканов они разваливаются на алкан и алкен.

