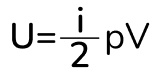- Умный справочник
- Физика
- Внутренняя энергия идеального газа. Изменение внутренней энергии. Работа в термодинамике
Внутренняя энергия идеального газа. Изменение внутренней энергии. Работа в термодинамике
Всем приветики! Сегодня мы с вами продолжаем изучать термодинамику и познакомимся с работой газа и внутренней энергией.
Начнем знакомство с новой темой именно с работы газа. И так, для начала нам нужно узнать тот факт, что не только газ может совершать работу, но и над газом тоже может совершаться работа. Какую работу может совершать газ? Например, в двигателях автомобилей газ совершает работу по выталкиванию поршня из цилиндра, а затем этот поршень вращает колеса и машина едет (детали опускаем). То есть для того, чтобы газ мог совершить работу ему нужно расшириться и что-то толкнуть. Это и есть и работы газа.
С другой же стороны, внешние силы тоже могут совершать работу над газом. То есть, когда мы говорим, что внешние силы совершили работу над газом это значит, что кто-то или что-то сжало газ.
Работа газа обозначается буквой А. Работа над газом обозначается буквой A’.
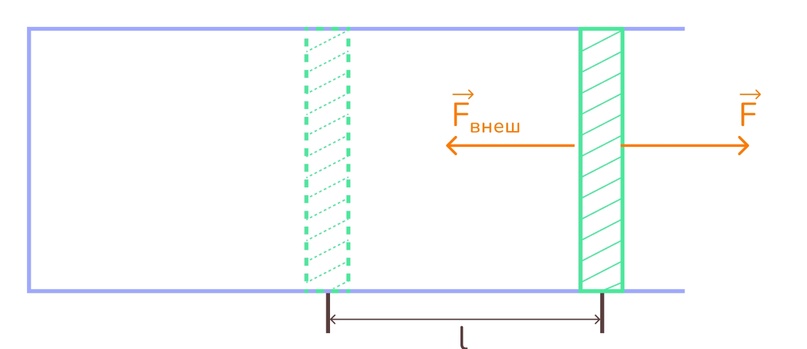
Давайте попробуем разобраться, как именно вычислять работу газа? Для этого рассмотрим горизонтальный цилиндр с поршнем, внутри которого находится газ. Вот рисуночек:
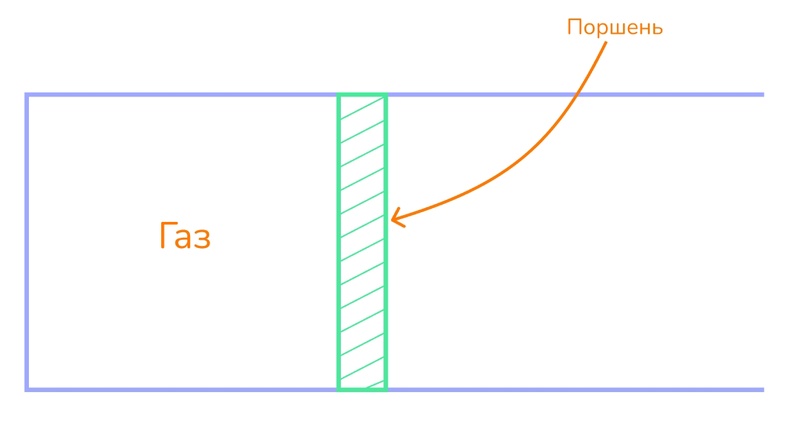
Давайте расставим силы, действующие на поршень. Это, естественно, сила давления самого газа F. Ну и для того чтобы поршень просто не вылетел, его должно что-то удерживать. И это просто какая-то внешняя сила Fвнеш, а значит эти силы равны по модулю.
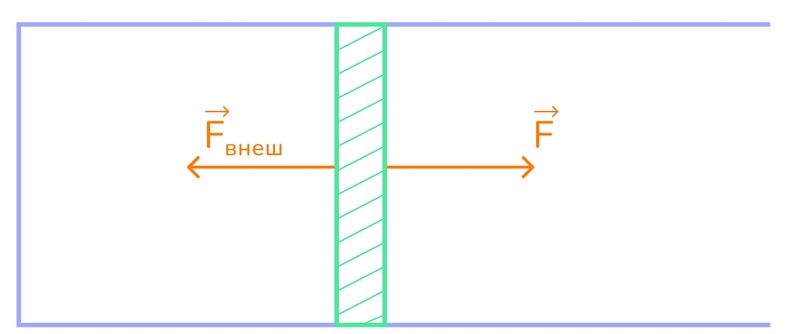
Ну теперь мы предполагаем, что поршень передвинулся под действием силы давления газа на расстояние l и будем считать, что давление газа не менялось, чтобы мы могли воспользоваться формулой работы постоянной силы.
Выразим работу газа (угол равен 0°, потому что сила действует в ту же сторону, что и перемещение):

Теперь выразим работу внешних сил над газом (угол равен 180°, потому что сила действует в обратную сторону от перемещения):
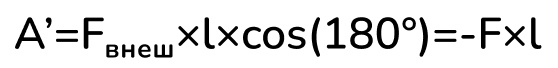
Отсюда мы получаем соотношение между работой газа и работой над газом:
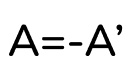
Теперь давайте научимся вычислять работу газа через его макро-характеристики. Для этого у нас, практически, все готово. Используем формулу работы постоянной силы давайте выразим саму силу через давление и площадь поршня S.
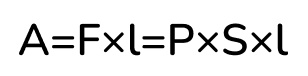
l – это и есть расстояние, на которое передвинулся поршень. Значит, произведение площади на длину – это и есть объем, на который расширился газ. То есть работа газа равна:
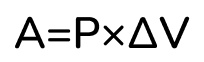
Но тут есть важное уточнение, эта формула работает только при постоянном давлении газа, то есть только при изобарном процессе.
Мы также можем сказать, чему равна работа в изохорном процессе? Так как работа газа – это его расширение, а при изохорном процессе объем не меняется, значит и работа газа равна нулю.
Также есть очень полезный лайфхак, чтобы вычислить работу газа можно просто найти площадь под графиком в координатах p-V.
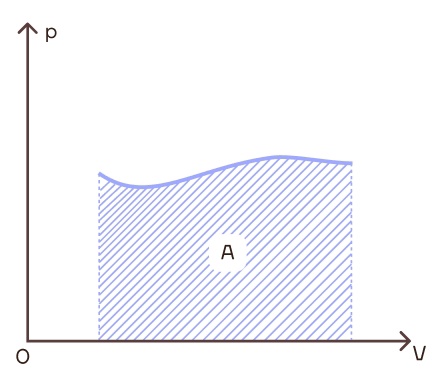
Ну и давайте подытожим:
- Газ совершает работу при изменении объема
- При расширении работа газа положительная, при сжатии – отрицательна
- Работа газа и работа над газом равны по модулю и противоположны по знаку
- Работу газа можно найти как площадь под графиком в координатах p-V
Теперь приступаем к внутренней энергии газа. Внутренняя энергия – это просто суммарная кинетическая энергия всех молекул газа.
Ну тут вообще все просто. Можем вывести формулу прямо из определения. Единственное, мы должны знать, что внутренняя энергия обозначается буквой U. То есть внутренняя энергия – это просто произведение числа молекул на среднюю кинетическую энергию одной молекулы:
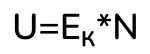
Вспомним формулы средней кинетической энергии молекулы и числа молекул:
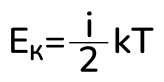
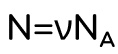
Подставляем эти формулы во внутреннюю энергию:
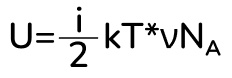
Вспоминаем, что произведение постоянной Больцмана на постоянную Авогадро – это универсальная газовая постоянная и получаем итоговую формулу:
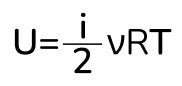
Вот мы и получили формулу для внутренней энергии, где i – это число степеней свободы газа. Тут сразу стоит отметить, что внутренняя энергия идеального газа зависит только от температуры. То есть если температура не меняется, то и внутренняя энергия тоже не меняется. Тут же напомню про степени свободы:
- i = 3 – одноатомный газ
- i = 5 – двухатомный газ
- i = 6 – многоатомный газ
Также давайте покажу вам еще прикольную штучку. Это другой вид формулы внутренней энергии. Для этого нам нужно наше любимое уравнение в молекулярной физике – это уравнение Менделеева-Клапейрона:
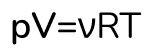
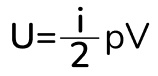
Объединим две формулы и получим: