- Умный справочник
- Физика
- Агрегатные состояния, тепловые процессы, агрегатные (фазовые) переходы. Уравнение теплового баланса
Агрегатные состояния, тепловые процессы, агрегатные (фазовые) переходы. Уравнение теплового баланса
Существует 3 агрегатных состояния вещества: твёрдое, жидкое и газообразное. Физические свойства вещества при переходе из одного агрегатного состояния в другое меняются, молекулы остаются неизменными.
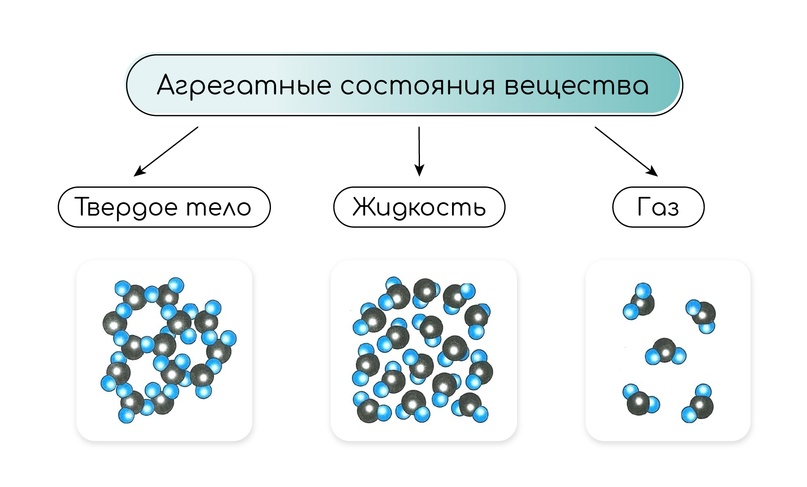
Помимо свойств для разных агрегатных состояний различны строение и внутренняя энергия.
Агрегатное состояние: газ (пар)
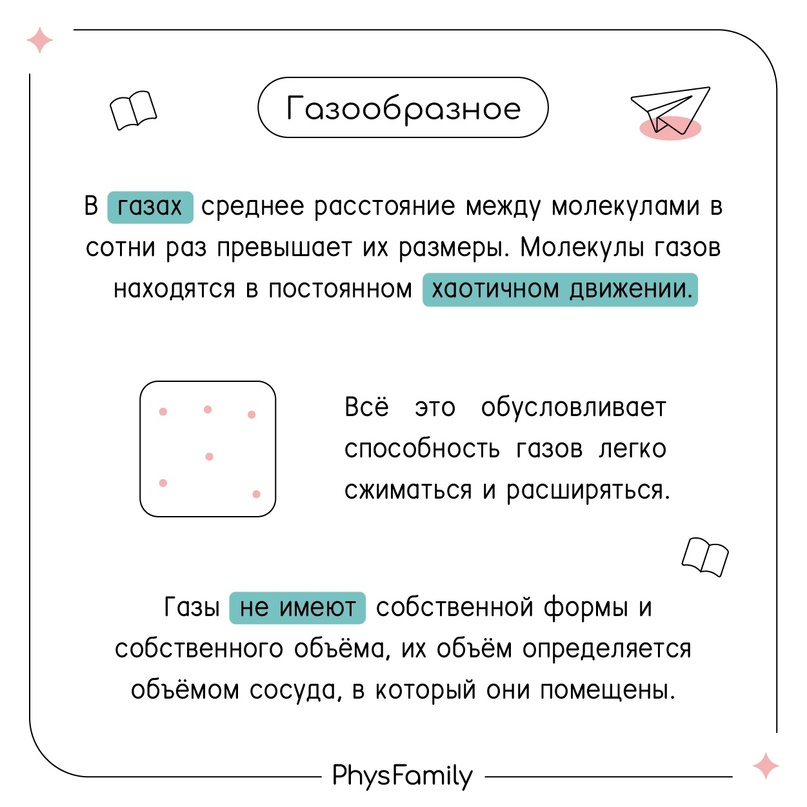
Потенциальная энергия молекул газа мала в сравнению с кинетической, так как расстояние между молекулами велико.
Переход вещества из одного агрегатного состояния в другое
Вследствие изменения величины сил взаимодействия между частицами вещества оно переходит из одного агрегатного состояния в другое. Агрегатное состояние вещества зависит от его температуры и давления.
Агрегатный (фазовый) переход — это изменение агрегатного состояния вещества. Например, газ может перейти в жидкость, то есть конденсироваться.
Агрегатное состояние: жидкость
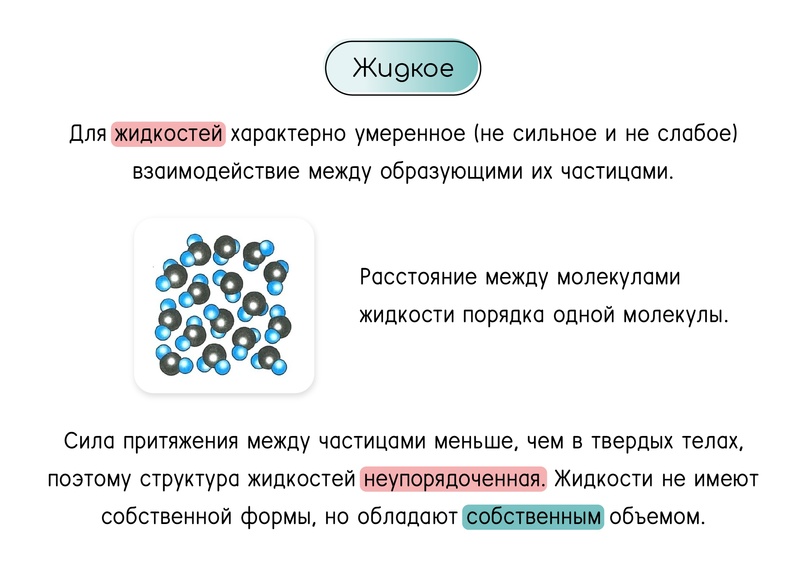
Потенциальная энергия молекул жидкости соизмерима с кинетической. Жидкости текучи, так как периодически частицы в них совершают прыжки.
Агрегатное состояние: твёрдое тело
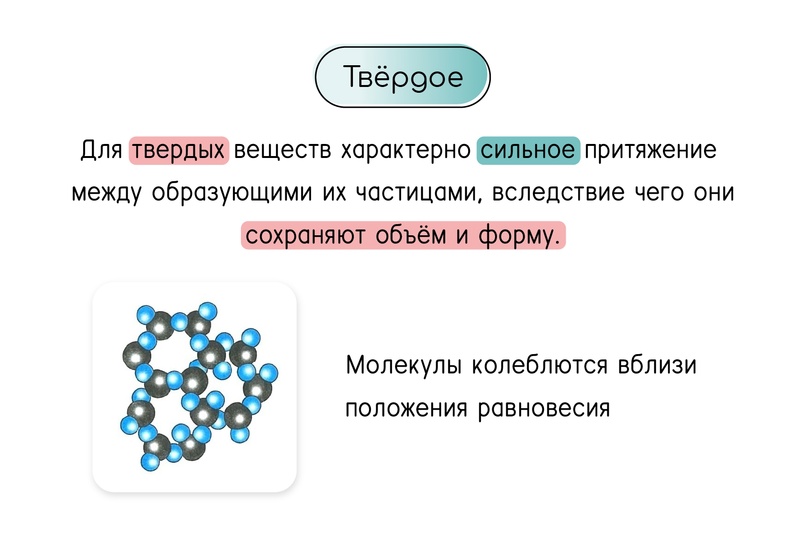
Сравнение трёх агрегатных состояний
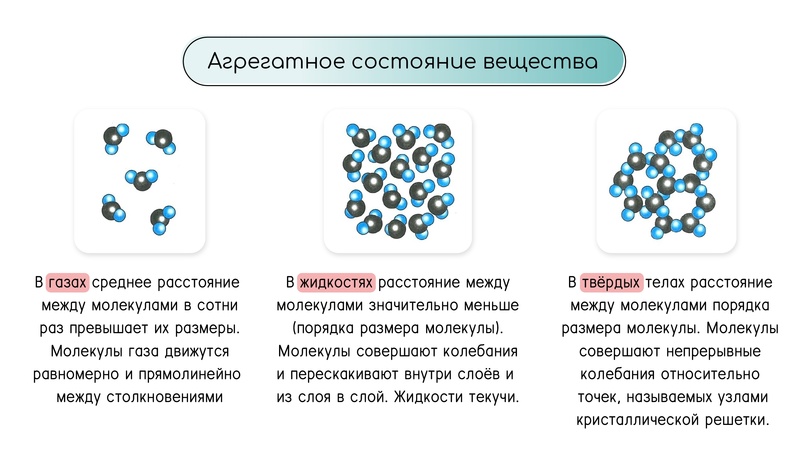
Тело может менять своё агрегатное состояние благодаря агрегатному переходу. Выделяют 6 агрегатных переходов, причём возможен переход из твёрдого состояния в газообразное минуя жидкое и наоборот.
Плавление, кристаллизация (отвердевание), парообразование (испарение и кипение), конденсация, сублимация (возгонка) и десублимация.
Основных агрегатных переходов 4, в школе не изучают сублимацию и десублимацию.
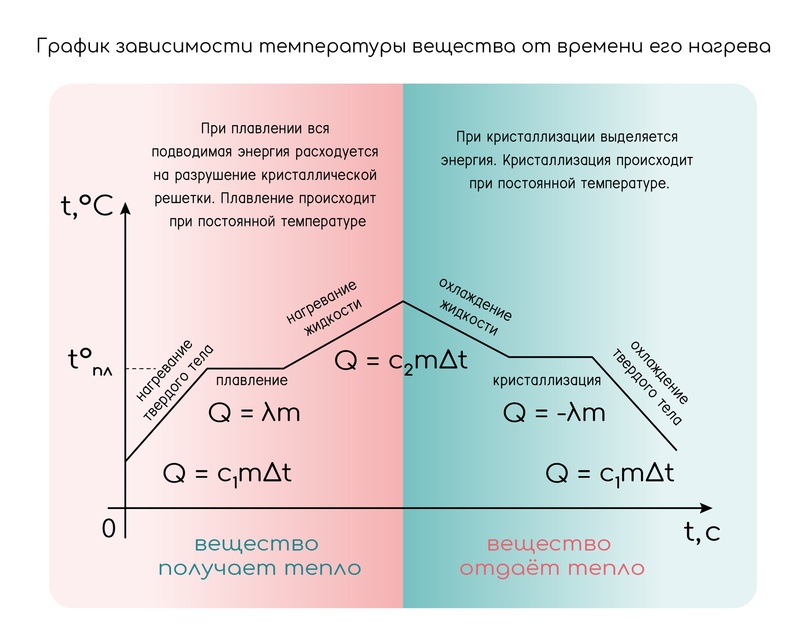
1-2) Плавление — переход вещества из твёрдого состояния в жидкое. Обратный переход называется кристаллизацией или отвердеванием. Оба процесса происходят при строго определённой температуре, называемой температурой плавления.
Температура плавления и температура отвердевания — это одно и то же.

3-4) Парообразование — переход вещества из жидкого состояния в газообразное. Переход из газа в жидкость называется конденсацией.

Виды парообразования
Парообразование происходит путём испарения или кипения жидкости. Формула выше используется для кипения, хотя постоянную L называют удельной теплотой парообразования, а не именно кипения.
Испарение — вид парообразования, происходящий с поверхности жидкости при любой температуре. Скорость испарения зависит от:
- рода жидкости. Та жидкость, молекулы которой притягиваются друг к другу с меньшей силой, испаряется быстрее (эфир быстрее воды)
- температуры жидкости. Чем горячее жидкость, тем быстрее она испаряется, так как чем выше температура жидкости, тем больше молекул, у которых кинетическая энергия выше потенциальной
- площади свободной поверхности (больше молекул могут вылетать)
- ветра. Ветер уносит вылетевшие с поверхности жидкости молекулы, не давая им возвращаться обратно в жидкость
Кипение (как и плавление) происходит также при строго определённой температуре, называемой температурой кипения. Конденсируется пар также при этой же температуре. И пока всё вещество не выкипит, его температура не поменяется.
С плавлением также — лёд плавится именно при нуле градусов Цельсия.
Про горение:
Горение (сгорание) топлива — это не фазовый переход, но важный тепловой процесс, так как при нём происходит выделение тепла. Количество теплоты, выделяемое при сгорании топлива, прямо пропроционально массе сжигаемого топлива (количества теплоты для плавления и парообразования тоже прямо пропорционально массе вещества)

Про графики процессов в ЕГЭ
В заданиях на ЕГЭ могут встретиться графики. Например, график зависимости температуры вещества с течением времени. Очень важно понимать на подобном графике, что происходит с веществом на каждом участке. Если температура тела растёт, то вещество нагревается; если падает - вещество охлаждается. А вот если температура не меняется, но время идёт, то тело меняет агрегатное состояние.
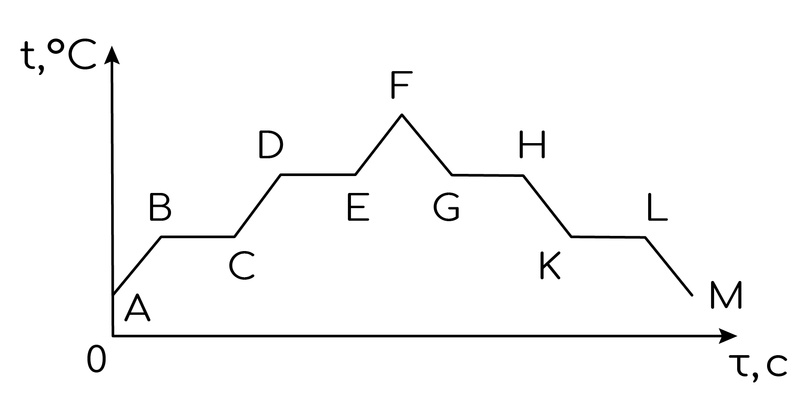
Если в начальный момент времени по условию тело находится в твёрдом агрегатном состоянии, тогда АВ - нагревание твёрдого тела; ВС - плавление твёрдого тела (понимаем это из того, что далее график идёт вверх); CD - нагревание жидкости; DE - кипение жидкости; EF - нагревание газа.
FG - охлаждение газа (пара);
GH - конденсация пара;
HK - охлаждение жидкости (так как график далее идёт вниз);
KL - кристаллизация (отвердевание); LM - охлаждение твёрдого тела.
Вот, например, график для твёрдого тела и жидкости:
Уравнение теплового баланса - закон сохранения энергии
Существует много задач на теплообмен. К примеру, в задаче могут добавить к 1 кг льда, находящемуся при температуре -20 °С, 0,2 кг воды при температуре +10 °С. Благодаря уравнению теплового баланса можно найти массу льдапри наступлении теплового равновесия.
При состоянии теплового равновесия прекращается теплопередача.
Тепловое равновесие — состояние термодинамической системы, при котором все макроскопические параметры остаются постоянными (неизменными) с течением времени.
Термодинамической системой является тело или система тел, которые могут взаимодействовать друг с другом. Если система не может обмениваться энергией с окружающей средой, её называют изолированной.
Какие параметры можно считать макроскопическими:
Макроскопические параметры — это параметры, которые относятся ко всей системе (например, давление, температура, объём, плотность и т.п.). При тепловом равновесии также прекращаются все агрегатные переходы.
Прежде всего в задачах на теплообмен нужно определить конечное состояние системы. В лёгких задачах происходит теплообмен без агрегатных переходов, в более сложных совершаются агрегатные переходы. В задаче в примере выше нужно понять, каким будет конечное состояние системы лёд-вода.
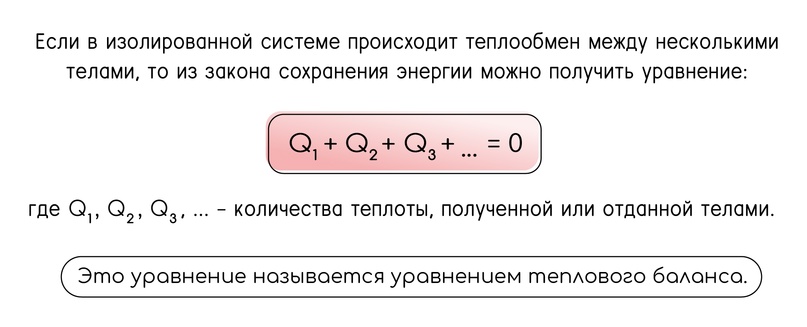
Для этого надо высчитать количество теплоты, необходимое для нагревания льда до температуры плавления, и сравнить его с количеством теплоты, которое может дать вода до начала кристаллизации. Далее используем уравнение теплового баланса, общий вид которого представлен на картинке ниже, и останется дело только за математическими вычислениями.
Q₁ = c₁m₁(0-t₁) = 2100 · 1 · (0-(-20)) = 42 000 Дж (количество теплоты, которое необходимо для нагревания льда до температуры плавления);
Q₂ = c₂m₂(0-t₂) = 4200 · 0,2 · (-10) = - 8 400 Дж (количество теплоты, которое теряет вода при охлаждении до начала отвердевания);
Q₁ > |Q₂|, следовательно, вода остынет до 0 ℃ и начнёт кристаллизоваться.
Q₃ = - λm₂ = - 330 000 · 0,2 = - 66 000 Дж (количество теплоты, которое выделится при кристаллизации воды).
Так как Q₁ < |Q₂| + |Q₃|, то только часть воды превратится в лёд, то есть в уравнении теплового баланса будем использовать Q₁, Q₂ и Q₄ = - λm₃, где m₃ - масса воды, которая кристаллизуется при достижении теплового равновесия. Далее необходимо применить уравнение теплового баланса, найти оттуда массу m₃, сложить с массой m₁ и получить ответ.